Tecnologia
Exército de ‘microrrobôs’ pode acabar com a placa dentária
Um bando de ‘microrrobôs’, guiados por ímãs, pode separar e remover o biofilme, ou placa.

Um bando de ‘microrrobôs’, guiados por ímãs, pode separar e remover o biofilme, ou placa. A inovação surgiu de uma parceria interdisciplinar entre odontólogos, biólogos e engenheiros.
Uma visita ao dentista geralmente envolve raspagem demorada, e sempre desagradável, com ferramentas mecânicas para remover a placa bacteriana dos dentes. E se, em vez disso, um dentista pudesse implantar um pequeno exército de minúsculos “robôs” para remover de forma precisa e não invasiva esse acúmulo bacteriano? É exatamente isso que pode estar a caminho dos consultórios odontológicos.
Um conjunto de pesquisadores composta por engenheiros, odontólogos e biólogos na Universidade da Pensilvânia desenvolveu uma microscópica equipe limpeza robótica. Com dois tipos de sistemas robóticos, os cientistas mostraram que “robôs” com atividade catalítica poderiam habilmente destruir biofilmes, aglutinações pegajosas de bactérias enredadas em uma armação protetora. Um dos sistemas projetado para trabalhar em superfícies e outro para operar em espaços confinados.
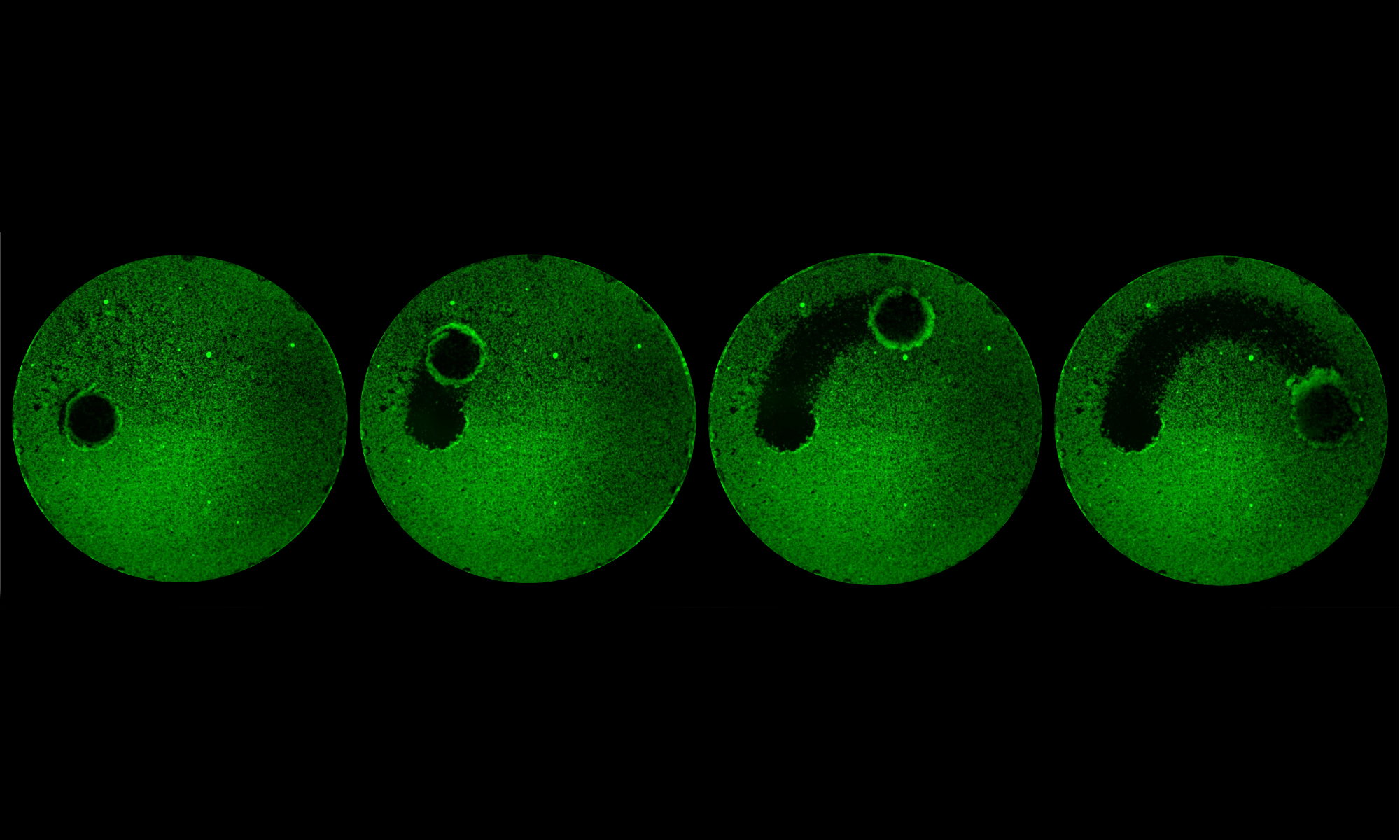
Com um movimento preciso e controlado, os microrrobôs removeram de uma placa de vidro um biofilme, como mostrado nesta sequência de imagens registradas ao longo da ocorrência do processo. Clique na imagem para ampliar. (Crédito: Geelsu Hwang e Edward Steager).
Esses sistemas robóticos de remoção de biofilme poderiam ser valiosos em uma ampla gama de aplicações potenciais, desde manter os tubos de água e cateteres limpos até reduzir o risco de cáries dentárias, infecções endodônticas e contaminação de implantes. A pesquisa, publicada na Science Robotics, foi conduzido por Hyun (Michel) Koo, da Faculdade de Medicina Dentária, e Edward Steager, da Faculdade de Engenharia e Ciências Aplicadas, ambas da Universidade da Pensilvânia, nos Estados Unidos.
“Essa foi uma interação verdadeiramente sinérgica e multidisciplinar”, diz Koo. “Estamos aproveitando a experiência de microbiologistas e cientistas clínicos, bem como engenheiros para projetar o melhor sistema de erradicação microbiana possível. Isso é importante para outros campos biomédicos que enfrentam biofilmes resistentes a medicamentos à medida que nos aproximamos de uma era pós-antibiótico”, em um comunicado.
“Tratar biofilmes que ocorrem nos dentes exige muito trabalho manual, tanto por parte do paciente quanto do profissional”, acrescenta Steager. “Esperamos melhorar as opções de tratamento, bem como reduzir a dificuldade de atendimento”.
Biofilmes podem surgir em superfícies biológicas, como em um dente ou em uma articulação, ou em objetos, como canos de água, implantes ou cateteres. Onde quer que os biofilmes se formem, eles são notoriamente difíceis de remover, já que a matriz pegajosa que contém as bactérias fornece proteção contra os agentes antimicrobianos.

O movimento dos “nanorrobôs” é dirigido por ímãs. Os pesquisadores preveem uma variedade de aplicações para a tecnologia, desde a limpeza dos dentes até a de canos de água e de cateteres. (Vídeo: Geelsu Hwang e Edward Steager)
Em trabalhos anteriores, Koo e demais pesquisadores da equipe fizeram progressos na quebra da matriz de biofilme com uma variedade de métodos inovadores. Uma estratégia tem sido empregar nanopartículas contendo óxido de ferro, que funciona catalizador, ativando o peróxido de hidrogênio para liberação de radicais livres. Esses, por sua vez, podem matar e destruir as bactérias nos biofilmes de maneira direcionada.
Por acaso, a equipe da Penn Dental Medicine descobriu que grupos da Penn Engineering, liderados por Steager, Vijay Kumar e Kathleen Stebe, estavam trabalhando com uma plataforma robótica que usava nanopartículas de óxido de ferro de modo muito similar ao usado com blocos para construção de microrrobôs. Os engenheiros controlam o movimento desses “robôs” usando um campo magnético, permitindo uma maneira livre de conduzi-los.
Juntos, a equipe interdisciplinar projetou, otimizou e testou dois tipos de sistemas robóticos, que o grupo chama de “robôs antimicrobianos catalíticos”, ou CARs (sigla para Catalytic Antimicrobial Robots), capazes de degradar e remover biofilmes. O primeiro envolve a suspensão de nanopartículas de óxido de ferro em uma solução, os quais podem então ser direcionados por ímãs para remover biofilmes de uma superfície de uma maneira similar a um arado. A segunda abordagem envolve a incorporação das nanopartículas em moldes de gel em formas tridimensionais. Esses foram usados para direcionar as nanopartículas e destruir os biofilmes nos tubos fechados, prevenindo entupimento pelos biofilmes de bactérias.
Ambos os tipos de CARs efetivamente mataram as bactérias, quebraram a matriz que as cercam e removeram os detritos com alta precisão. Depois de testar os “robôs” em biofilmes que crescem em uma superfície de vidro plano ou em tubos de vidro fechados, os pesquisadores experimentaram uma aplicação clinicamente mais relevante: a remoção de biofilme de partes difíceis de serem alcançadas em um dente humano.
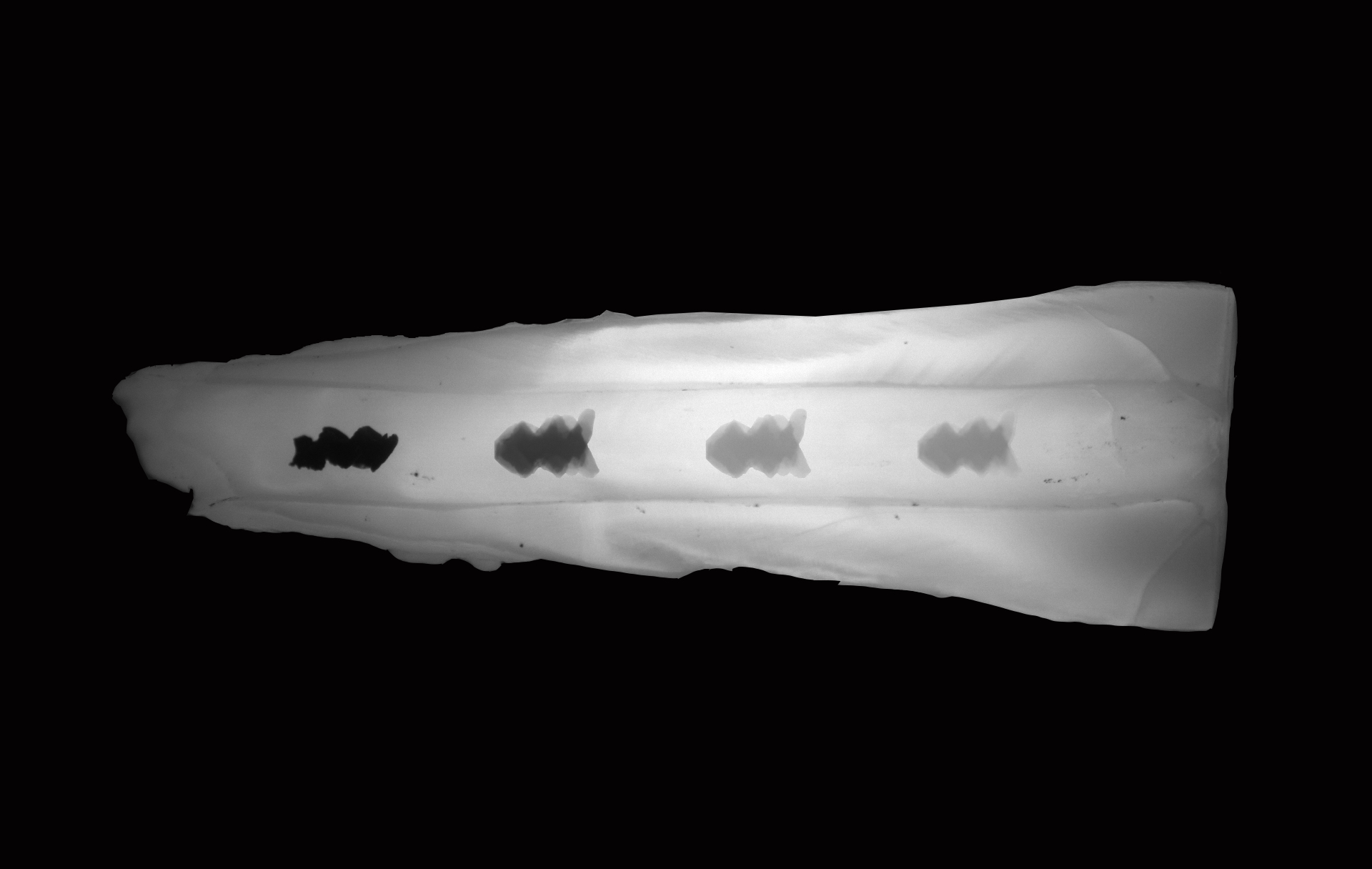
Os microrrobôs da equipe da Universidade da Pensilvânia foram eficazes na limpeza de superfícies difíceis de alcançar. Esta imagem, em um decurso de tempo, mostra um dos robôs moldados em forma helicoidal viajando dentro de um canal dentário. (Imagem: Alaa Babeer, Elizabeth E. Hunter e Hyun Koo)
Os CARs foram capazes de degradar e remover biofilmes bacterianos não apenas de uma superfície dentária, mas de uma das partes mais difíceis de acessar de um dente, o istmo, um corredor estreito entre os canais radiculares, onde os biofilmes comumente proliferar.
“Os tratamentos existentes para a placa (biofilme) são ineficazes porque são incapazes de degradar simultaneamente a matriz protetora, matando as bactérias incorporadas e removendo fisicamente os produtos biodegradados”, diz Koo. “Estes robôs podem fazer todos os três ao mesmo tempo de forma muito eficaz, não deixando vestígios de biofilme.”
Ao remover os restos degradados do biofilme, diz Koo, a chance de ele se estabilizar e voltar a crescer diminui substancialmente. Os pesquisadores imaginam direcionar precisamente esses “nanorrobôs” para onde eles precisarem para remover biofilmes, seja o interior de um cateter ou uma linha de água ou superfícies de dentes difíceis de alcançar.
“Pensamos em robôs como sistemas automatizados que realizam ações com base em informações coletadas ativamente”, diz Steager. Nesse caso, diz ele, “o movimento do robô pode ser informado por imagens do biofilme coletado de microcâmeras ou outros modos de imagens médicas”.
Esse estudo foi financiado em parte pelo Instituto Nacional de Pesquisa Dental e Craniofacial e National Science Foundation (NSF), uma agência do governo dos Estados Unidos que dá suporte a pesquisas. A inovação pode um dia seguir o caminho da aplicação clínica. Para isso, os pesquisadores estão recebendo os pesquisadores prosseguem com o estudo. [Universidade da Pensilvânia]


Aproveite nossas ofertas imperdíveis
Garimpamos as promoções mais quentes da internet para você economizar no que realmente vale a pena.
VER OFERTAS