A Tabela Periódica dos Elementos Químicos, também conhecida como Classificação Periódica dos Elementos Químicos, tem a função de reunir e organizar todos os elementos químicos já descobertos pelo ser humano. Essa ferramenta foi desenvolvida em 1869 pelo químico russo Dmitri Mendeleev, que agrupou os elementos por propriedades semelhantes, além de colocá-los em ordem crescente de massa.
Em 1913, o físico inglês Henry Moseley, aprimorou a Tabela Periódica com seu método de determinação dos números atômicos. Os elementos passaram, então, a serem colocados em ordem crescente de números atômicos, assumindo a apresentação que conhecemos atualmente.
Tabela Periódica completa
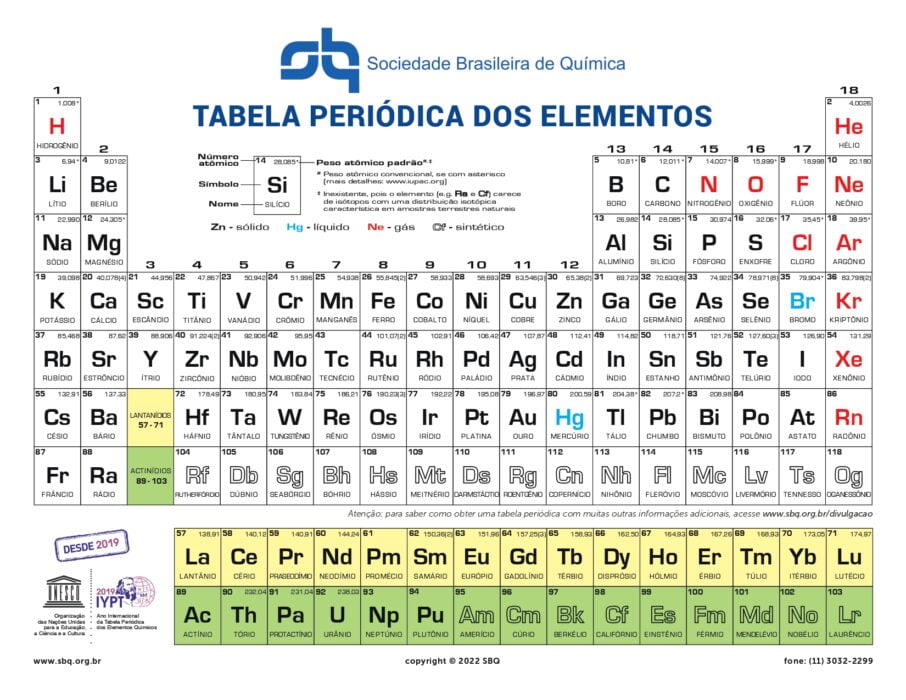
Você pode baixar essa tabela em maior definição aqui.
Entendendo a Tabela Periódica
Confira agora o que você precisa saber para entender a Tabela Periódica
Organização da Tabela Periódica
A Tabela Periódica é importante para estabelecer padrões para a organização de todos os elementos químicos descobertos pelo homem até o momento. Hoje são 118 elementos químicos.
Os elementos estão listados na Tabela em ordem de números atômicos, de forma crescente, da esquerda para a direita. Dessa forma, o primeiro elemento a aparecer é o hidrogênio (número atômico igual a 1) e o último é o oganessônio (número atômico igual a 118, o foi recém-incluído. As linhas com o número atômico são chamadas de períodos.
Além de listar os elementos, a Tabela também os agrupa em colunas de acordo com suas propriedades físico-químicas semelhantes. As colunas da Tabela Periódicas são chamadas de grupos.
Grupos
Cada coluna da Tabela Periódica é um grupo (chamado de família, em alguns materiais didáticos) que reúne elementos de propriedades físico-químicas semelhantes. A única exceção é o hidrogênio, que aparece listado no grupo 1, mas não possui propriedades semelhantes a nenhum dos outros elementos químicos.
Há duas formas de se referir aos grupos da Tabela Periódica: por seus números ( grupo 7, grupo 8) ou pelo nome do primeiro elemento do grupo, como por exemplo: grupo do Carbono, grupo do Nitrogênio.
Vale destacar que alguns grupos trazem nomes conhecidos, porque foram descobertos antes do desenvolvimento da Tabela:
- Metais alcalinos (grupo 1, com exceção do hidrogênio)
- Metais alcalino-terrosos (grupo 2)
- Pinictogênios (grupo 15)
- Calcogênios (grupo 16)
- Halogênios (grupo 17)
- Gases nobres (grupo 18)
Outra divisão ainda muito difundida é a separação dos grupos em A e B, sendo A, o lado esquerdo e B, lado direito; os grupos de ferro, cobalto e níquel ficam como fronteira entre os dois grupos.
No entanto, a União Internacional da Química Pura e Aplicada (Iupac, do inglês International Union of Pure and Applied Chemistry) não indica mais a utilização dessas categorizações, remendando a utilização dos números de 1 a 18, pois a padronização evita confusões, principalmente para estudantes.
Períodos
Já vimos que as colunas são os grupos, agora veremos que as linhas horizontais são chamadas de períodos. O período indica em qual camada está o elétron mais energético do elemento químico. No momento, a Tabela Periódica conta com sete períodos.
Lantanídeos e os actinídeos
É importante ressaltar o caso dos lantanídeos e actinídeos. O lantânio, La, número atômico 57 é localizado no sexto período da Tabela, pertencendo ao grupo 3. Os 14 elementos que o seguem, do cério (Ce, número atômico 58) ao lutécio (Lu, número atômico 71), são chamados de lantanídeos.
Da mesma forma, o actínio (Ac, número atômico 89), localizado no sétimo período, no grupo 3. Os outros 14 elementos que aparecem após ele, do tório (Th, número atômico 90) ao laurêncio (Lr, número atômico 103), são chamados de actinídeos.
Juntos, lantanídeos e os actinídeos são 30 elementos químicos. Dessa forma, eles são organizados em duas linhas, fora da tabela. Isso porque a inclusão de todos esses elementos, deixaria a tabela esteticamente confusa.
Algumas subdivisões dos elementos da tabela periódica
Os elementos da Tabela Periódica também podem ser divididos entre o grupo dos elementos representativos e o grupo dos elementos de transição.
Elementos representativos
Os elementos representativos são todos os elementos químicos pertencentes aos grupos 1, 2, 13, 14, 15, 16, 17 e 18. Eles possuem, dependendo do grupo, de 1 a 8 elétrons no último nível. Entre esses grupos, temos os metais alcalinos, alcalinos terrosos, calcogênios, halogênios e gases nobres. Esses elementos podem ser encontrados na natureza.
Elementos de transição
Os Elementos de transição, também conhecidos como metais de transição, são intermediários entre os elementos metálicos, que ficam à esquerda da Tabela Periódica, e os elementos não metálicos, postos à esquerda.
Propriedades periódicas
A Tabela não é chamada de Periódica à toa. Alguns atributos dos elementos químicos ocorrem com uma periodicidade, em outras palavras, os elementos com esses atributos se repetem de maneira regular. São propriedades periódicas:
- Raio atômico: é um atributo que pode ser utilizado para dimensionar o tamanho dos átomos. Quanto mais à esquerda e mais abaixo, maior o raio do elemento.
- Energia de ionização: para se retirar um elétron de valência de um átomo isolado no estado gasoso é necessário energia. Essa energia é chamada de ionização. Quanto menor for o átomo, mais difícil será a retirada do elétron de valência.
- Afinidade eletrônica: caso um elétron se conecte a um átomo isolado na fase gasosa, há uma variação de energia chamada afinidade eletrônica. Quando muita energia é liberada nesse processo, isso indica que o átomo tem grande afinidade por elétrons. Geralmente, átomos menores possuem maior afinidade eletrônica.
- Eletronegatividade: é quando o átomo atrai elétrons para si em uma ligação química.
- Densidade: na tabela, o elemento mais denso é o Ósmio (Os), dessa forma, os elementos dispostos mais próximos ao ósmio são mais densos que os mais distantes.
- Pontos de fusão e ebulição: a mesma lógica da densidade é seguida aqui. O elemento de maior ponto de fusão é o Tungstênio (W) e o de maior ponto de ebulição é o Rênio (Re). Quanto mais próximo de um desses elementos, maiores serão seus pontos de fusão e ebulição.
Origem e história da Tabela Periódica

Como vimos no início, a Tabela Periódica foi criada por Dmitri Mendeleev, no entanto, o trabalho do químico russo baseado em diversos cientistas. Saberemos agora alguns desses antecedentes.
Em seu Tratado Elementar de Química, de 1789, Antoine-Laurent Lavoisier, químico francês, listou 33 elementos, gases, metais, não metais e elementos terrosos. 25 desses elementos estão na Tabela Periódica atual.
Mais tarde, em 1817, o químico alemão Johann Wolfgang Döbereiner apresentou a chamada lei das tríades, em que agrupava trios de elementos de acordo com suas propriedades químicas.
Anos depois, em 1862, Alexandre-Émile Béguyer de Chancourtois, um geólogo francês, desenvolveu a classificação tridimensional chamada de parafuso telúrico, em que organizava os elementos em uma hélice, em ordem crescente de massa atômica.
Em 1863, o químico britânico John Alexander Reina Newlands criou a lei das oitavas, em que organizava os elementos de propriedades semelhantes em 11 grupos. Essas propriedades se repetiam após oito elementos.
Já em 1860, no Congresso de Karlsruhe, 129 químicos haviam se reunido para padronizar as pesquisas químicas, diferenciando termos como átomo e molécula. O italiano Stanislao Cannizzaro, um dos palestrantes, apresentou um estudo sobre um novo sistema de massas atômicas. Dmitri Mendeleev e também o alemão Julius Lothar Meyer estavam entre os presentes. Baseado nas ideias de Cannizzaro, Meyer desenvolveu uma tabela com 28 dos 56 elementos já conhecidos.
Em 1868, Meyer trabalhava em uma Tabela Periódica que incluía todos os elementos químicos conhecidos, porém, em 1869, Mendeleev publicou então a sua versão da Tabela. A proximidade das publicações ocasionou conflitos, mas a Tabela de Mendeleev vigorou, pois previa a existência de elementos ainda não descobertos, levando em consideração diversas propriedades físicas e químicas, conseguindo, inclusive, prever quais seriam as propriedades dos elementos a serem descobertos.
No entanto, a Tabela Periódica de Mendeleev não é definitiva, trata-se de um instrumento de pesquisa, sempre aberto a revisões e adições. O próprio Mendeleev realizou alterações posteriores. O escocês William Ramsay, por exemplo, no final do século XIX, incluiu na Tabela os gases nobres.
Quem determina a estrutura oficial e padrão da Tabela Periódica atualmente é a Iupac, assim como é esse órgão que regulariza as mudanças e possíveis adições de novos elementos descobertos.
Curiosidades sobre a Tabela Periódica
- Infelizmente, a versão original da Tabela criada por Mendeleev foi perdida.
- Conta-se que Mendeleev se inspirou no jogo de cartas Paciência para organizar sua Tabela Periódica.
- Quando o argônio (Ar) foi descoberto, em 1894, não se encaixava em nenhum dos grupos da Tabela de Mendeleev. Dessa forma, o químico negou a existência do elemento.
- J é a única letra do alfabeto que não aparece na Tabela Periódica.
- O Guiness Book, o livro dos recordes, coloca o plutônio (Pu) como o elemento mais perigoso da Tabela Periódica, já que é altamente radioativo e é utilizado na confecção de bombas atômicas.





