Pela primeira vez nos Estados Unidos, foi utilizada uma ferramenta de edição de genes para tratar câncer avançado em três pacientes, a técnica mostrou resultados iniciais promissores em um estudo clínico de fase 1. Até agora, o tratamento parece seguro, e mais resultados são esperados em breve.
Para desenvolver um tratamento mais seguro e mais eficaz para os doentes oncológicos, cientistas da Universidade da Pensilvânia, do Instituto Parker de Imunoterapia oncológica de São Francisco e da Tmunity Therapeutics, uma empresa de biotecnologia na Filadélfia, desenvolveram uma versão avançada da imunoterapia. Neste tratamento, as células imunes de um paciente são removidas do corpo, treinadas para reconhecer células cancerígenas específicas e, finalmente, injetadas de volta no paciente, onde elas se multiplicam e as destroem.
Ao contrário da quimioterapia ou da radioterapia, que mata diretamente as células cancerosas, a imunoterapia ativa o sistema imunológico do próprio corpo para fazer o trabalho. Essa pesquisa usou uma ferramenta de edição de genes chamada CRISPR para alterar as células imunes, transformando-as em soldados treinados para localizar e matar células cancerosas. Usando esta técnica, a equipe esperou desenvolver uma forma mais eficaz de imunoterapia com efeitos colaterais mínimos.
Fui formado como cientista farmacêutico e engenheiro biomolecular, e estava particularmente interessado em aprender sobre esta nova terapia porque o meu laboratório se concentra na edição dos editores de genes. Em particular, estou tentando desenvolver editores de genes ainda melhores baseados em CRISPR para o diagnóstico e tratamento de câncer e outras doenças. Combinamos química, biologia e nanotecnologia para criar, controlar e fornecer ferramentas de edição de genes de forma mais eficiente e precisa.
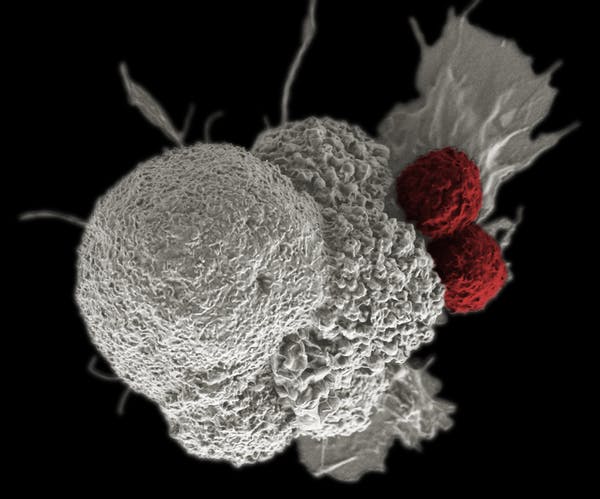
Treinar as células imunes para encontrar e matar o câncer
O primeiro passo para a criação destas células assassinas de tumores utilizadas no ensaio do medicamento contra o câncer foi isolar os glóbulos brancos ( também conhecidos como células T) – um tipo de células brancas do sangue que combate patógenos e células cancerosas – do sangue dos pacientes com câncer. Dois pacientes com mieloma múltiplo avançado e um paciente com lipossarcoma mixoide/célula redonda foram incluídos neste estudo.
Para armar as células T e reforçar suas habilidades de combate a tumores sem prejudicar as células normais, os cientistas modificaram geneticamente as células T – desativando três genes e adicionando um gene – antes de devolvê-los aos pacientes.
Os dois primeiros desses genes eliminados codificam receptores de glóbulos brancos, que são proteínas encontradas na superfície dos glóbulos brancos que podem reconhecer e ligar moléculas específicas, conhecidas como antígenos, em células cancerosas. Quando esses células T modificadas se ligam a esses antígenos, isso permite que elas ataquem e matem diretamente as células cancerosas. Mas o problema é que uma única célula T pode reconhecer múltiplos antígenos diferentes no corpo, tornando-os menos focados em encontrar as células cancerosas. Ao eliminar esses dois genes, as células T são menos propensas a atacar o alvo errado ou o hospedeiro, um fenômeno chamado autoimunidade,
Além disso, eles interromperam um terceiro gene, chamado proteína da morte celular programada 1, que retarda a resposta imune. A desativação do gene da proteína da morte celular programada 1 melhora a eficiência das células T.
O passo final na transformação destas células foi adicionar um gene que produz um novo receptor de células T que reconhece e agarra-se a um marcador específico nas células cancerosas chamado NY-ESO-1. Com três genes eliminados e um adicionado, as células T estão agora prontas para combater o câncer.
Onde está a CRISPR neste ensaio clínico?
Então, como exatamente essa equipe editou uma célula T? Eles utilizaram a tecnologia de edição de genes CRISPR/Cas9 que usa dois componentes: uma molécula CRISPR guia que encontra e liga o local do gene alvo; e uma tesoura molecular, Cas9, que corta o DNA, desativando o gene.
A equipe usou a eletroporação, uma tecnologia que cria buracos temporários na membrana celular, para entregar a proteína Cas9 junto com as moléculas guia que visavam os três genes de interesse em milhões de células T.
Depois de interromper os três genes com CRISPR, a equipe usou um vírus seguro e desativado para entregar um gene à célula T que lhe permitiria reconhecer o marcador específico de câncer – NY-ESO-1. Remover esses genes de milhões de células e então permitir que as células T se multipliquem em bilhões de células fora do corpo em placas de petri pode levar de vários dias a semanas.
Quatro dias antes de injetar as células T modificadas por CRISPR, a equipe deu a cada um dos três pacientes várias doses de drogas quimioterápicas para esgotar os glóbulos brancos existentes em seus corpos.
Finalmente, aproximadamente 100 milhões de células T modificadas por quilograma de peso corporal foram injetadas nos pacientes como uma única infusão.
Futuro promissor da CRISPR
A equipe monitorou os pacientes continuamente durante os primeiros 28 dias após a injeção das células T. Em seguida, eles os acompanharam mensalmente por seis meses; depois disso, a cada três meses, monitorando quaisquer eventos adversos, como reação imune. A terapia com células T é frequentemente associada a vários efeitos colaterais, como febre, dor muscular, dores de cabeça, confusão, convulsões, pressão arterial baixa, distúrbios hemorrágicos e disfunção de múltiplos órgãos. A equipe não notou sinais de toxicidade em nenhum paciente, o que é animador.
Mas o primeiro paciente com mieloma múltiplo avançado tinha continuado o crescimento de um tumor após 60 dias. Embora o tratamento não parecesse tão bem sucedido para o primeiro paciente, o ensaio clínico de fase 1 foi concebido principalmente para testar a segurança, e a equipe não relatou qualquer toxicidade para qualquer paciente.
O segundo paciente com lipossarcoma de células redondas/mIXOID avançado foi monitorado usando tomografias computadorizadas em série e parecia estável após 90 dias. O terceiro paciente com mieloma múltiplo iniciou o estudo recentemente e é muito cedo para qualquer resultado. O fato de que não houve problemas sérios de toxicidade com esta nova terapia envolvendo a tecnologia de edição de genes baseada em CRISPR em pacientes com câncer é um passo notável para o amplo uso na clínica.
Por
Este artigo foi publicado originalmente no The Conversation, Leia o original aqui.

