Três pesquisadores que desenvolveram uma tecnologia no coração da era dos smartphones – e sua transformação social resultante – ganharam o Prêmio Nobel de Química em 2019. O trabalho de John B. Goodenough, M. Stanley Whittingham e Akira Yoshino fez avanços cruciais nas baterias de íons de lítio, que armazenam grandes quantidades de energia em pequenas células de bateria e são rápidas e fáceis de recarregar.
LEIA TAMBÉM: Nova tecnologia promete fornecer energia e água potável a milhões de pessoas
Vendidos pela primeira vez comercialmente em 1991 pela Sony em suas filmadoras, esses tipos de baterias servem para muito mais do que produtos eletrônicos portáteis. Eles estão no centro de duas outras revoluções tecnológicas com o poder de transformar a sociedade: a transição de motores de combustão interna para veículos elétricos e a mudança de uma rede elétrica movida a combustíveis fósseis para geradores de energia renovável que armazenam eletricidade excedente em baterias de uso futuro.
Então, como essas baterias funcionam? Cientistas e engenheiros passaram carreiras inteiras tentando construir baterias melhores e ainda existem mistérios que não entendemos completamente. A melhoria das baterias exige que químicos e físicos examinem as mudanças no nível atômico, bem como engenheiros mecânicos e elétricos que podem projetar e montar as baterias que alimentam os dispositivos. Como cientista de materiais da Universidade de Washington e do Pacific Northwest National Lab, meu trabalho ajudou a explorar novos materiais para baterias de lítio-ar, baterias de magnésio e, é claro, baterias de íon-lítio.
Vamos considerar um dia na vida de dois elétrons. Vamos nomear um deles como Alex e ele tem um amigo chamado George.
Anatomia da bateria
Alex mora dentro de uma bateria alcalina AA padrão, como as que você utiliza na lanterna ou no controle remoto. Dentro de uma bateria AA, há um compartimento cheio de zinco e outro cheio de óxido de manganês. Em uma extremidade, o zinco apenas se prende fracamente a elétrons como Alex. Por outro lado, o óxido de manganês puxa poderosos elétrons em sua direção. No meio, impedindo que os elétrons passem diretamente de um lado para o outro, há um pedaço de papel embebido em uma solução de potássio e água, que coexiste como íons positivos de potássio e íons negativos de hidróxido.

Quando a bateria é colocada em um dispositivo e ligada, o circuito interno do dispositivo é concluído. Alex é puxado para fora do zinco, através do circuito e no óxido de manganês. Ao longo do caminho, seu movimento alimenta o dispositivo, a lâmpada ou o que estiver conectado à bateria. Quando Alex sai, ele não pode voltar: o zinco que perdeu um elétron se liga ao hidróxido para formar óxido de zinco. Este composto é extremamente estável e não pode ser facilmente convertido novamente em zinco.
LEIA TAMBÉM: Abelha robô movida a energia solar pode voar sem restrições
Do outro lado da bateria, o óxido de manganês obtém um átomo de oxigênio da água e deixa íons de hidróxido para trás para equilibrar o hidróxido consumido pelo zinco. Depois que todos os vizinhos de Alex deixaram o zinco e passaram para o óxido de manganês, a bateria está esgotada e precisa ser reciclada.
Vantagens do íon de lítio
Vamos comparar isso com George, que vive em uma bateria de íons de lítio. As baterias de íon de lítio têm os mesmos componentes básicos das células AA alcalinas, com algumas diferenças que conferem grandes vantagens.
LEIA TAMBÉM: IA prestes a desenvolver energia de fusão ilimitada
George vive em grafite, que é ainda mais fraca que o zinco ao segurar elétrons. E a outra parte da bateria é o óxido de cobalto e lítio, que puxa elétrons com muito mais força do que o óxido de manganês – o que dá à bateria a capacidade de armazenar muito mais energia na mesma quantidade de espaço que uma bateria alcalina. A solução que separa a grafite e o óxido de cobalto e lítio contém íons de lítio com carga positiva, que formam e quebram facilmente ligações químicas à medida que a bateria é descarregada e recarregada.
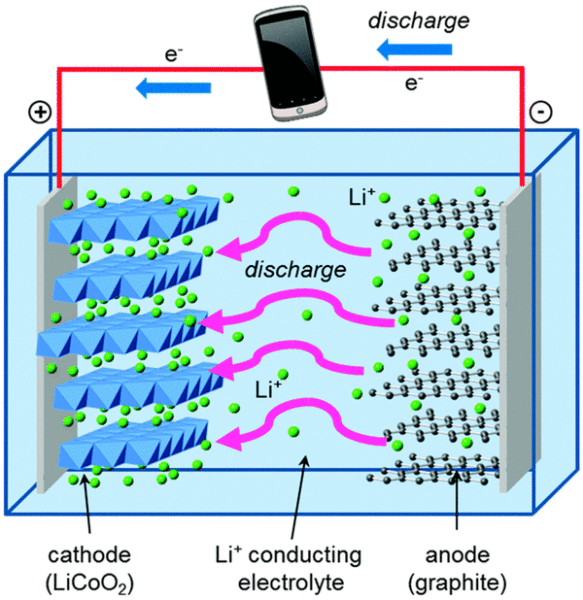
Essas reações químicas são reversíveis, ao contrário da formação de óxido de zinco, que é o que permite que os elétrons e os íons de lítio fluam para frente e para trás ao longo de muitos ciclos de carga e descarga.
Esse processo não é 100% eficiente – todas as baterias acabam perdendo a capacidade de reter energia. No entanto, as baterias de químicas de íons de lítio tem sido poderosa o suficiente para dominar a tecnologia de baterias atualmente.

